Molekulare Mechanismen der Neurodegeneration
Forschungsgruppe der Klinik für Psychiatrie und Psychotherapie
Wir interessieren uns für die zugrundeliegenden molekularen Mechanismen neurodegenerativer Erkrankungen, insbesondere der Alzheimer-Demenz (AD). Dazu nutzen wir neuropathologische, molekularbiologische, biochemische und verhaltensbiologische Untersuchungsmethoden. Es werden u.a. Mausmodelle der AD eingesetzt um den Zusammenhang zwischen Lern- und Gedächtnisdefiziten und pathologischen Hirnveränderungen zu untersuchen.
Auswahl aktueller Projekte
Der Einfluss von Umweltfaktoren auf die Entwicklung der Alzheimer-Erkrankung
In mehreren aktuellen Studien untersuchen wir den Einfluss von Umweltfaktoren wie z.B. körperlicher Aktivität oder Ernährungsgewohnheiten auf pathologische Veränderungen in Mausmodellen der Alzheimer-Erkrankung. Dazu nutzen wir u.a. das sogenannte „Enriched Environment“-Paradigma, in dem z.B. durch Laufräder und verschiedene Spielzeuge eine reizangereicherte Umgebung angeboten wird. Dabei konnten wir feststellen, dass gesteigerte körperliche Aktivität mit einer ausgeprägten Verbesserung von Lerndefiziten, einem abgeschwächten Nervenzellverlust und einer deutlich gesteigerten Neubildung von Nervenzellen im Gehirn dieser Mäuse einhergeht (z.B. Hüttenrauch et al., Transl Psych 2016; Hüttenrauch et al., Front Mol Neurosci 2016; Gerberding et al., ASN Neuro 2019; Stazi und Wirths, Behav Brain Res 2021). Kürzlich konnten wir zeigen, dass auch Ernährungsfaktoren wie Koffein einen positiven Einfluss auf Lern- und Gedächtnisdefizite im Tiermodell haben können (Stazi et al., Cell Mol Life Sci 2022; Stazi et al., Eur Arch Psych Clin Neurosci 2023; Stazi et al., Int J Mol Sci 2023).
Referenzen:
Gerberding A.-L., Zampar S., Stazi M., Liebetanz D., Wirths O. (2019) Physical activity ameliorates impaired hippocampal neurogenesis in the Tg4-42 mouse model of Alzheimer’s disease. ASN Neuro, 1759091419892692, https://doi.org/10.1177/1759091419892692
Hüttenrauch M., Brauß A., Kurdakova A., Borgers H., Klinker F., Liebetanz D., Salinas-Riester G., Wiltfang J., Klafki H.W., Wirths, O. (2016) Physical activity delays hippocampal neurodegeneration and rescues memory deficits in an Alzheimer disease mouse model. Translational Psychiatry, 6: e800, https://doi.org/10.1038/tp.2016.65
Hüttenrauch M., Salinas G., Wirths O. (2016) Effects of long-term environmental enrichment on anxiety, memory, hippocampal plasticity and overall brain gene expression in C57BL6 mice. Frontiers in Molecular Neuroscience, 9:62, https://doi.org/10.3389/fnmol.2016.00062
Stazi M., Wirths O. (2021) Physical activity and cognitive stimulation ameliorate learning and motor deficits in a transgenic mouse model of Alzheimer’s disease. Behavioural Brain Research, 397: 112951, https://doi.org/10.1016/j.bbr.2020.112951
Stazi M., Lehmann S., Sakib M.S., Pena-Centeno T., Büschgens L., Fischer A., Weggen S., Wirths O. (2022) Long-term caffeine treatment of Alzheimer mouse models ameliorates behavioural deficits and neuron loss and promotes cellular and molecular markers of neurogenesis. Cellular and Molecular Life Sciences, 79(1): 55, https://doi.org/10.1007/s00018-021-04062-8
Stazi M., Zampar S., Nadolny M., Büschgens L., Meyer T., Wirths O. (2023) Combined long-term enriched environment and caffeine supplementation improve memory function in C57Bl6 mice. European Archives of Psychiatry and Clinical Neuroscience, 273: 269-281, https://doi.org/10.1007/s00406-022-01431-7
Stazi M., Zampar S., Klafki H.W., Meyer T., Wirths O. (2023) A combination of caffeine supplementation and enriched environment in Alzheimer's disease mouse model. International Journal of Molecular Sciences, 24(3): 2155, https://doi.org/10.3390/ijms24032155
Rolle aminoterminal modifizierter Abeta-Peptide bei der Alzheimer-Erkrankung
Die Ablagerung von sogenannten Amyloid-beta (Abeta) Peptiden in Form extrazellulärer Plaques gehört zu den neuropathologischen Hauptmerkmalen der Alzheimer-Erkrankung. Neben den, durch sequentielle Spaltung des Amyloid-Vorläuferproteins (APP) durch beta- und gamma-Sekretase gebildeten Abeta1-40 und Abeta1-42 Peptiden, gibt es weitere, aminoterminal veränderte Peptidvarianten (Wirths und Zampar, Expert Opin Ther Targets 2019). Dazu gehören u.a. verkürzte Abeta-Peptide die mit der Aminosäure Phenylalanin an Position 4 (Abeta4-x) beginnen und im Gehirn von Alzheimer-Patienten sowie in Mausmodellen der Alzheimer-Erkrankung gefunden wurden (Wirths et al., Alzheimers Res Ther 2017; Zampar et al., Neuropathol Appl Neurobiol 2020; Bader et al., Life 2023), aber auch solche die N-terminal verlängert (z.B. Abeta-3-40) (Klafki et al., Int J Mol Sci 2020; Klafki et al., J Neurochem 2022) oder post-translational modifiziert sind (Liepold et al., J Am Soc Mass Spectrom 2023; Schrempel et al., Acta Neuropathol 2024). Kürzlich konnten wir die Metalloprotease ADAMTS4 als ein Enzym identifizieren, das an der Bildung von Abeta4-x Peptiden aber auch N-terminal verlängerten Abeta-Varianten beteiligt ist (Walter et al., Acta Neuropathol 2019; Wirths et al., Neuropathol Appl Neurobiol 2024). Ferner untersuchen wir einen möglichen Einfluss dieser modifizierten Peptide auf Myelinisierung und die Rolle dieser Peptide in Oligodendrozyten (Depp et al., Nature 2023; Sasmita et al., Nat Neurosci 2024), da ADAMTS4 im Gehirn stark in diesem speziellen Zelltyp exprimiert wird.
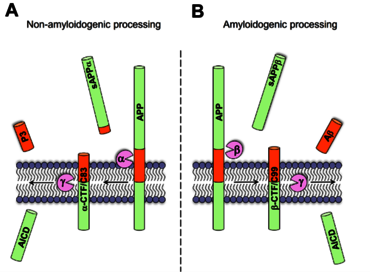
Abb. 1a: Während der enzymatische Schnitt durch das Enzym alpha-Sekretase die Bildung von Amyloid-beta Peptiden aus dem APP-Molekül verhindert (A), entstehen diese durch sequentielle Spaltung durch beta- und gamma-Sekretase (B).
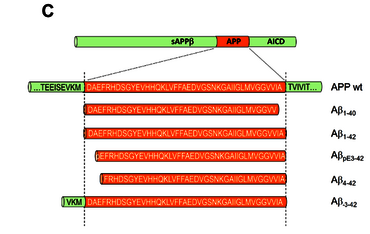
Abb. 1b: Abeta-Peptide kommen in einer Vielzahl von Varianten vor, die am Amino- oder Carboxyterminus modifiziert sind (z.B. verkürzt oder verlängert) (C).
Referenzen:
Bader A.S., Gnädig M.U., Fricke M., Büschgens L., Berger L.J., Klafki H.W., Meyer T., Jahn O., Weggen S., Wirths O. (2023) Brain region-specific differences in amyloid-beta plaque composition in 5XFAD mice. Life, 13: 1053, https://doi.org/10.3390/life13041053
Depp C., Sun T., Sasmita A.O., Spieth L., Berghoff S.A., Nazarenko T., Overhoff K., Steixner-Kumar A.A., Subramanian S., Arinrad S., Ruhwedel T., Möbius W., Göbbels S., Saher G., Werner H.B., Damkou A., Zampar S., Wirths O., Thalmann M., Simons M., Saito T., Saido T., Krueger-Burg D., Kawaguchi R., Willem M., Haass C., Geschwind D., Ehrenreich H., Stassart R., Nave K.-A. (2023) Myelin dysfunction drives amyloid deposition in mouse models of Alzheimer’s disease. Nature, 613: 349-357, https://doi.org/10.1038/s41586-023-06120-6
Klafki H.W., Wirths O., Mollenhauer B., Liepold T., Rieper P., Esselmann H., Vogelgsang J., Wiltfang J., Jahn O. (2022) Detection and quantification of Abeta-3-40 (APP669-711) in cerebrospinal fluid. Journal of Neurochemistry, 160: 578-589, https://doi.org/10.1111/jnc.15571
Klafki H.W., Morgado B., Wirths O., Jahn O., Bauer C., Schuchhardt J., Wiltfang J. (2022) Is plasma amyloid-beta 1-42/1-40 a better biomarker for Alzheimer’s disease than Abeta x-42/x-40? Fluids and Barriers of the CNS, 19(1): 96, https://doi.org/10.1186/s12987-022-00390-4
Liepold T, Klafki H.W., Kumar S., Walter J., Wirths O., Wiltfang J., Jahn O. (2023) Matrix development for the detection of phosphorylated amyloid-beta peptides by MALDI-TOF-MS. Journal of the American Society for Mass Spectrometry, 34(3): 505-512, https://doi.org/10.1021/jasms.2c00270
Sasmita A.O., Depp C., Nazarenko T., Sun T., Siems S.B., Ong E.C., Nkeh Y.B., Boehler C., Yu X., Bues B., Evangelista L., Mao S., Morgado B., Wu Z., Ruhwedel T., Subramanian S., Börensen F., Overhoff K., Spieth L., Berghoff S.A., Sadleir K.R., Vassar R., Eggert S., Goebbels S., Saito T., Saido T., Saher G., Möbius W., Castelo-Branco G., Klafki H.W., Wirths O., Wiltfang J., Jäkel S., Yan R., Nave K.A. (2024) Oligodendrocytes produce amyloid-beta and contribute to plaque formation alongside neurons in Alzheimer’s disease model mice.Nature Neuroscience, 27: 1668-1674, https://doi.org/10.1038/s41593-024-01730-3
Schrempel S., Kottwitz A.K., Piechotta A., Gnoth K., Büschgens L., Hartlage-Rübsamen M., Morawski M., Schenk M., Kleinschmidt M., Serrano G.E., Beach T.G., Rostagno A., Ghiso J., Heneka M.T., Walter J., Wirths O., Schilling S., Roßner S. (2024) Identification of isoAsp7-Abeta as a major Abeta variant in Alzheimer’s disease, dementia with Lewy bodies and vascular dementia.Acta Neuropathologica, 148: 78 https://doi.org/10.1007/s00401-024-02824-9
Walter S., Jumpertz T., Hüttenrauch M., Ogorek I., Gerber H., Storck S.E., Zampar S., Dimitrov M., Lehmann S., Lepka C., Berndt C., Wiltfang J., Becker-Pauly C., Beher D., Pietrzik C.U., Fraering P., Wirths O*. and Weggen S*. (2019) The metalloprotease ADAMTS4 generates N-truncated Abeta4-x peptides and marks oligodendrocytes as a pro-amyloidogenic cell lineage in Alzheimer’s disease. Acta Neuropathologica, 137: 239-257 (*corresponding authors), https://doi.org/10.1007/s00401-018-1929-5
Wirths O., Lehnen C., Fricke M., Talucci I., Klafki H.-W., Morgado B., Lehmann S., Münch C., Liepold T., Wiltfang J., Rostagno A., Ghiso J., Maric H.M., Jahn O., Weggen S. (2024) Amino-terminally elongated Abeta-3-x peptides are generated by the secreted metalloprotease ADAMTS4 and deposit in a subset of Alzheimer’s disease brains. Neuropathology Applied Neurobiology, 50(3): e12991, https://doi.org/10.1111/nan.12991
Wirths O., Walter S., Kraus I., Klafki H.W., Stazi M., Oberstein T., Ghiso J., Wiltfang J., Bayer T.A., Weggen S. (2017) N-truncated Abeta4-x peptides in sporadic Alzheimer's disease cases and transgenic Alzheimer mouse models. Alzheimer’s Research & Therapy, 9(1): 80, https://doi.org/10.1186/s13195-017-0309-z
Wirths O., Zampar S. (2019) Emerging roles of N- and C-terminally truncated Abeta peptides in Alzheimer’s disease. Expert Opinion on Therapeutic Targets, 23(12): 991-1004, https://doi.org/10.1080/14728222.2019.1702972
Zampar S., Klafki H.W., Sritharen K, Bayer T.A., Wiltfang J., Rostagno A., Ghiso J., Miles L.A., Wirths O. (2020) N-terminal heterogeneity of parenchymal and vascular amyloid-beta deposits in Alzheimer’s disease. Neuropathology Applied Neurobiology, 46: 273-285, https://doi.org/10.1111/nan.12637
Rolle von Signaltransduktionskaskaden bei Entzündungsprozessen und neurodegenerativen Erkrankungen
Zunehmende Hinweise belegen, dass Entzündungsprozesse eine wichtige Rolle beim Krankheitsbild der AD spielen. Aktivierte Mikrogliazellen finden sich konzentriert in der Nähe von Amyloid-beta-Ablagerungen und scheinen über Phagozytoseprozesse an deren Beseitigung (Hüttenrauch et al., Acta Neuropathol Commun 2018; Aichholzer et al., Alzheimers Res Ther 2021), aber auch ursächlich an der Amyloid-beta Ablagerung beteiligt zu sein (Kaji et al., Immunity 2024). Sogenannte STAT-Proteine (Signal-Transduktoren und Aktivatoren der Transkription) sind wichtige Transkriptionsfaktoren (Menon et al., BBA – Mol Cell Res 2021; Menon et al., Cell Commun Signal 2022; Remling et al., Cell Commun Signal 2023), die eine Rolle bei den pathophysiologischen Veränderungen entzündlicher Erkrankungen (Sheik et al., Cell Commun Signal 2025; Annawald et al., Cell Commun Signal 2025) spielen können. Wir wollen mit Hilfe geeigneter Mausmodelle gezielt die Funktion dieser STAT-Proteine im Kontext der Alzheimer-Krankheit untersuchen und besonders deren Rolle in Mikrogliazellen näher beleuchten (Kaji et al., Immunity 2024; Büschgens et al., Cell Commun Signal 2025).
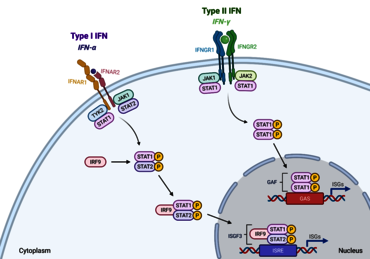
Abb. 2: Übersicht über den JAK-STAT Signalweg. Nach der Bindung von Zytokinen und Wachstumsfaktoren führt die Rezeptordimerisierung zur Rekrutierung von JAK, anschließender Tyrosinphosphorylierung und Bildung einer STAT-Andockstelle. Nach der Tyrosinphosphorylierung trennen sich die STATs vom Rezeptor und bilden Homo- oder Heterodimere, bevor sie in den Zellkern gelangen und die Transkription von Zielgenen aktivieren (Büschgens et al., 2025).
Referenzen:
Aichholzer F., Klafki H.W., Ogorek I., Vogelgsang J., Wiltfang J., Scherbaum N., Weggen S., Wirths O. (2021) Evaluation of cerebrospinal fluid glycoprotein NMB (GPNMB) as a potential biomarker for Alzheimer’s disease. Alzheimer’s Research & Therapy, 13: 94, https://doi.org/10.1186/s13195-021-00828-1
Annawald K., Gregus A., Wirths O., Meyer T. (2025) Characterization of a pathogenic gain-of-function mutation in the N-terminal domain of STAT1 which is reported to be associated with eosinophilic esophagitis. Cell Communication & Signaling, 23: 367, https://doi.org/10.1186/s12964-025-02330-9
Büschgens L., Hempel N., Methi A., Fischer A., Siering N., Piepkorn L., Jahn O., Meyer T., Wirths O. (2025) Behavioral assessment and gene expression changes in a STAT1 targeted-disruption mouse model. Cell Communication & Signaling, 23: 305 https://doi.org/10.1186/s12964-025-02313-w
Hüttenrauch M., Ogorek I., Klafki H.W., Otto M., Stadelmann C., Weggen S., Wiltfang J. Wirths O. (2018) Glycoprotein NMB: a novel Alzheimer’s disease associated marker expressed in a subset of activated microglia. Acta Neuropathologica Communications, 6(1): 108, https://doi.org/10.1186/s40478-018-0612-3
Kaji S., Berghoff S.A., Spieth L., Sasmita A.O., Büschgens L., Kedia S., Schlapphoff L., Zirngibl M., Nazarenko T., Damkou A., Vitale S., Hosang L., Depp C., Kamp F., Scholz P., Ewers D., Ischebeck T., Wurst W., Wefers B., Schifferer M., Willem M., Nave K.-A., Haass C., Arzberger T., Jäkel S., Wirths O., Saher G., Simons M. (2024) Apolipoprotein E aggregation in microglia initiates Alzheimer’s disease pathology by seeding beta-amyloidosis. Immunity, 57: 2651-2668, https://doi.org/10.1016/j.immuni.2024.09.014
Menon P.R., Doudin A., Gregus A., Wirths O., Staab J., Meyer T. (2021) The anti-parallel dimer conformation of STAT3 is required for the inactivation of cytokine signal transduction. Biochimica et Biophysica Acta – Molecular Cell Research, 1868(12): 119118, https://doi.org/10.1016/j.bbamcr.2021.119118
Menon P.R., Staab J., Gregus A., Wirths O., Meyer T. (2022) An inhibitory effect on the nuclear import of phospho-STAT1 by its unphosphorylated form. Cell Communication & Signaling, 20(1):42, https://doi.org/10.1186/s12964-022-00841-3
Remling L., Gregus A., Wirths O., Meyer T., Staab J. (2023) A novel interface between the N-terminal and coiled‑coil domain of STAT1 functions in an autoinhibitory manner. Cell Communication & Signaling, 21: 170, https://doi.org/10.1186/s12964-023-01124-1
Sheikh S.M., Staab J., Bleyer M., Ivetic A., Lüder F., Wirths O., Meyer T (2025) Amino-terminal truncation of STAT1 transcription factor causes CD3- and CD20-negative non-Hodgkin lymphoma through upregulation of STAT3-mediated oncogenic functions.Cell Communication & Signaling, 23: 201, https://doi:10.1186/s12964-025-02183-2
Wissenschaftliche Kollaborationen
Intern:
- Prof. Dr. Jens Wiltfang/ Dr. Hans Klafki/ Prof. Dr. Olaf Jahn/ Prof. Dr. Andre Fischer, Klinik für Psychiatrie und Psychotherapie
- Prof. Dr. Christine Stadelmann-Nessler/ Dr. Stefan Nessler, Institut für Neuropathologie
- Prof. Dr. mult. Thomas Meyer, Psychosomatische Medizin und Psychotherapie
Extern:
- Prof. Dr. Sascha Weggen, Institut für Neuropathologie, Universitätsklinikum Düsseldorf
- Prof. Jorge Ghiso, Dept. of Pathology/Dept. of Psychiatry, New York University
- Prof. Dr. Claus Pietrzik, Institut für Pathobiochemie, Universität Mainz
- Dr. Hans-Michael Maric, Rudolf-Virchow-Zentrum, Universität Würzburg
Preise/Drittmittel
- Alzheimer Forschung Initiative
- Alzheimer Stiftung Göttingen
- Gerhard Hunsmann Stiftung
- Deutsche Forschungsgemeinschaft, GRK2824
Kontakt
Leitung

Kontaktinformationen
- Telefon: +49 551 3965669
- E-Mail-Adresse: owirths(at)gwdg.de
Mitarbeiter*innen
Kontaktinformationen
- Telefon: +49 551 3920968
- E-Mail-Adresse: merle.fricke(at)med.uni-goettingen.de
Kontaktinformationen
- Telefon: +49 551 3962298
- E-Mail-Adresse: mohammed.hassan(at)med.uni-goettingen.de
Kontaktinformationen
- Telefon: +49 551 3968358
- E-Mail-Adresse: nishi.arora(at)med.uni-goettingen.de

Kontaktinformationen
- Telefon: +49 551 3968358
- E-Mail-Adresse: marzieh.enayati(at)med.uni-goettingen.de
Das könnte Sie auch interessieren